Unique Device Identification#
Allgemein#
Als Hersteller von Medizinprodukten sind Sie zur Vereinfachung von Rückverfolgbarkeiten (insbesondere bei möglichen Rückrufen) und zur Vermeidung von Fälschungen, dazu angehalten, sich an die Regularien der einmaligen Produkterkennung (Unique Device Identification) zu halten.
Hierbei müssen vor dem Markteintritt eines Medizinprodukts, dem Produkt selbst und allen höheren Verpackungsebenen des Produkts eine UDI zugewiesen werden.
Mit dem UDI-Modul haben Sie die Möglichkeit, die Daten, welche für eine Meldung in die GUDID-Datenbank bzw. EUDAMED-Datenbank benötigt werden, vorzuhalten.
Zur Meldung von UDI-Daten können alle erforderlichen Daten erfasst werden.
Hinweis
Unique Device Identification (UDI) ist ein Freischaltmodul, dessen Nutzung nur mit einer zusätzlichen Lizenz sowie Aktivierung in der Moduleinrichtung möglich ist.
Abkürzungen#
| Abkürzung | Beschreibung |
|---|---|
| DUNS | Data Universal Numbering System |
| EUDAMED | European Database on Medical Devices |
| GUDID | Global Unique Device Identification Database |
| GUDID Data Elements Reference Table | Übersicht über die UDI-Stammdaten der GUDID |
| UDI | Unique Device Identification |
| UDI Data Dictionary | Übersicht der UDI-Stammdaten veröffentlicht durch die EU-Kommission. |
| XML | Extensible Markup Language |
| XSD | XML Scheme Definition |
UDI Benutzereinrichtung#
In der "UDI Benutzereinrichtung“ können Sie pro BenutzerIn die Berechtigungen zum Ausführen von Arbeitsvorgängen, wie zum Beispiel das Freigeben von EUDAMED- oder GUDID-Daten festlegen. Hierzu setzen Sie ein Häkchen in die Felder, die den entsprechenden Vorgang beschreiben, für welchen die ausgewählten BenutzerInnen Berechtigungen erhalten sollen.
Einrichtungen UDI - EUDAMED in KUMAVISION#
Nachfolgend werden Ihnen die notwendigen UDI Einrichtungen für die EUDAMED Datenbank beschrieben.
UDI Einrichtung#
In der "UDI Einrichtung“ werden die grundlegenden Einrichtungen auf dem Inforegister "Allgemein“ und "EUDAMED“ wie folgt vorgenommen:
| Feld | Beschreibung |
|---|---|
| Standard Zuteilungsstelle | Gibt die Standard Zuteilungsstelle an. |
| Standard Hersteller SRN | Gibt die Standard SRN des Herstellers an. |
Funktionsaufrufe#
Menüband Aktionen#
| Funktion | Beschreibung |
|---|---|
| Neue Base DI | Erstellt eine neue DI (BASIC-DI, UDI-DI, Secondary). |
Menüband Zugehörig - Stammdaten#
Unter dem Menüpunkt "Zugehörig“ > "Stammdaten“ > "EUDAMED“ haben Sie die Möglichkeit zur zentralen Stammdatenpflege. Dabei sind die folgenden Beschreibungen aus dem UDI Data Dictionary der Europäischen Kommission entnommen:
| Funktion | Beschreibung |
|---|---|
| CMR Categories | “Mentions if the Device has a CMR (Carcinogenic,Mutagenic or toxic to Reprodution (CMR) ) substance in it`s composition” |
| Clinical Size Types | "Device Clinical Sizes can be provided if applicable. Several Clinical Sizes can be added for the Device. Clinical Size will be defined by the Type, Precizion, Value (either Range, single value or Text) and Measuring Unit. The Type of Clinical Size (example : length, width, etc.)” |
| Device Certificate Types | “When registering the Device, for Devices covered by Product certificates, user will have to provide identification details of the Product Certificate covering the Device. Property defines the type of Product Certificate associate with the Device.” |
| Issuing Entities | "Assigned Issuing Entities that will generate the DI Codes allocated for all DI`s inside Eudamed (Basic UDI DI, UDI-DI, Unit of Use DI, Secondary Di, Package level DI). The Commission shall designate one or several entities to operate a system for assignment of UDIs ('issuing entity')” |
| EMDN Codes | "The Nomenclature Code(s) associated with the UDI-DI. The corresponding CND Nomenclature Code will be stored in the field” |
| Measure Units | “Device Clinical Sizes can be provided if applicable. Several Clinical Sizes can be added for the Device. Clinical Size will be defined by the Type, Precizion, Value (either Range, single value or Text) and Measuring Unit. Clinical Size Measure Unit” |
| Multi Component Devices | “Property defines if the Basic UDI-DI is refering to a System which is a Device in itself, Procedure pack which is a Device in itself (in accordance with the Art. 22(4) MDR) or Kit. Property is applicable for Standard Devices (not Systems or Procedure Packs). Option Kit is only applicable in case of IVDR Devices and System which is a Device in itself, Procedure pack which is a Device in itself are applicable only in case of MDR Devices” |
| Non Medical Devices Type (Annex XVI) | Field stores the reference to the Intended purpose other than medical of the Device (UDI-DI). Field stores the values regarding the Intended purpose of the Device other the medical one`s as they are descubed in the Annex XVI of MDR Regulation.“ |
| Notified Bodies | "When registering the Device, for Devices covered by Product certificates, user will have to provide identification details of the Product Certificate covering the Device. Property stores the reference to the Notified Body that issued the Product Certificate” |
| Risk Classes | “Risk Class of the Device associated with the Basic UDI-DI. Device Risk Class is dependent directly on the Applicable Legislation of the Device.” |
| Special Devices | "Property defines if the Device is a Special Device Type anf if so, the type of Special device Type. In case the Device is a Standard Device having the option System or Procedure Pack (which is a Device in itself) or a System or Procedure Pack - field is not supplied.” |
| Storage Handling Conditions | "References the Storage and Handling Conditions associated to the Device (UDI-DI)” |
| Type of Substances | "Field stores the details regarding the type of medicinal substance registered (Substance which can be considered a Medicinal Product or Substance which may be considered a medicinal product derived from human blood or plasma)” |
| Warning Values | "Field stores the Type of Critical Warnings or Contra-Indications, being required in this case.” |
| Product Designer | “Details of the Product Designer (Original Manufacturer) who Manufactured (produced) or Designed the Device. Reference to an Organisation details provided in case the Manufacturer that designed and manufactured the device is not present in EUDAMED.” |
| Base DI Liste | Liste sämtlicher (auch vergebener) DIs (BASIC-DI, UDI-DI, Secondary DI usw.). |
| Änderungsliste | Liste sämtlicher Änderungen zu UDI Informationen. |
Menüband Zugehörig - UDI#
| Funktion | Beschreibung |
|---|---|
| Base DI Liste | Öffnet die zentrale Liste der hinterlegten DIs |
| Product Designers | Gibt das Unternehmen an, das das Gerät ursprünglich hergestellt oder entwickelt hat. |
| Änderungsliste | Öffnet dir Änderungsliste, welche die Änderungen, welche an den UDI-Informationen vorgenommenen wurden, anzeigt. |
Base DI Liste#
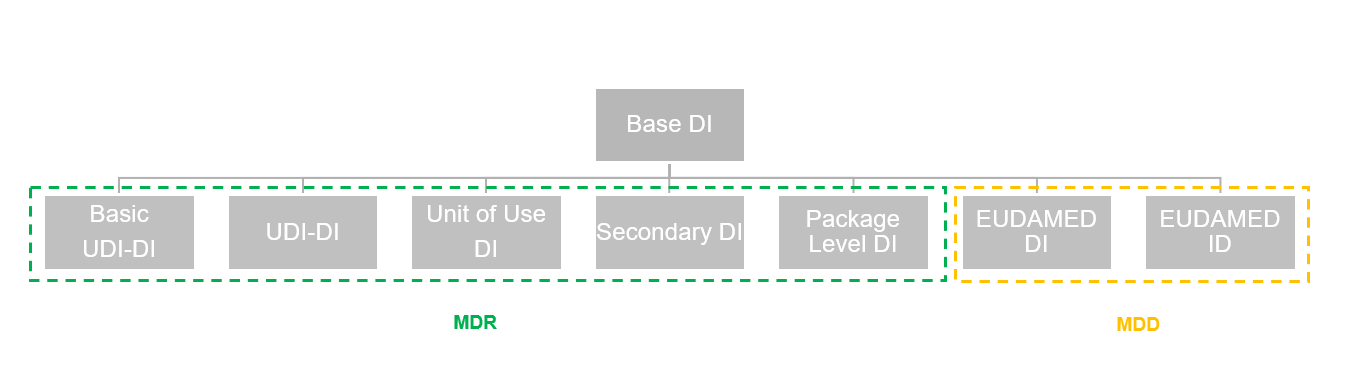
Bei dieser Liste handelt es sich um die zentrale Liste in der sämtliche DIs hinterlegt sind. Dies gilt sowohl für DIs welche bereits verwendet werden, als auch für nicht verwendete DIs welche bei den entsprechenden Zuteilungsstellen erworben wurden.
Nachfolgende Grafik demonstriert, welche DIs welchen Regularien für die EUDAMED Datenbank unterliegen:
| Feld | Beschreibung |
|---|---|
| Code | Enthält die entsprechende UDI-DI (z.B. GTIN oder HIBC). |
| Zuteilungsstelle | Enthält die entsprechende Zuteilungsstelle (z.B. GS1). |
| Beschreibung | Optionales Feld zur näheren Beschreibung des UDI Datensatzes welches nicht in die EUDAMED (bzw. GUDID) gemeldet wird. |
| DI Art | Beschreibt die DI Art. Zur Auswahl stehen: • None: Dient als Platzhalter für DIs, die vorab bereits erworben, jedoch noch nicht zugewiesen wurden. • Basic UDI-DI • UDI-DI • Unit of Use DI • Secondary DI • Package Level DI • EUDAMED DI • UDI-DI (Legacy) |
| Verwendung in EUDAMED | Gibt an, ob die DI, Teil eines EUDAMED Datensatzes ist. |
Menüband#
Je nach Auswahl der DI Art, stehen Ihnen folgende Aufrufe im Menüband zur Verfügung:
| Funktion | Beschreibung |
|---|---|
| EUDAMED Datensatz erstellen | Erstellt einen EUDAMED Datensatz (Basic UDI-DI, UDI-DI und EUDAMED DI). |
| Neu | Erstellt eine neue Zeile in der Base DI Liste. |
| Audit Trail | Öffnet das Änderungsprotokoll des EUDAMED Datensatzes. |
| Öffne DI Karte | Öffnet den EUDAMED Datensatz. |
| Öffne DI Versionen | Öffnet die DI Versionsübersicht. |
| Öffne Artikelverknüpfungen | Öffnet die zum EUDAMED Datensatz gehörige Artikelverknüpfung. |
Basic UDI-DI Karte#
Die Basic UDI-DI Stammdaten können in der Basic UDI-DI Karte eingegeben werden. Hierzu wählen Sie zunächst einen Datensatz aus der "Base DI Liste“ aus, welcher die "DI Art = Basic UDI-DI“ aufweist. Rufen Sie sich anschließend den Menüpunkt "EUDAMED Datensatz erstellen“ für die Erstanlage oder "Öffne DI-Karte“ zur Bearbeitung einer bereits bestehenden Karte, auf.
Die Felder sind entsprechend des UDI Data Dictionary zu befüllen. Felder, die nicht dem Data Dictionary entstammen sind in Deutsch und im Folgenden aufgeführt:
Inforegister Allgemein#
| Feld | Beschreibung |
|---|---|
| Beschreibung | Es kann ein freier Beschreibungstext zugewiesen werden. |
| Freigegeben | Gibt an, ob die Version des Datensatzes freigegeben wurde. |
| Aktiv | Kennzeichnet die Version welche aktuell bearbeitet wird oder zuletzt bearbeitet wurde. |
| Interne Version | Gibt die Version an. |
Menüband#
| Funktion | Beschreibung |
|---|---|
| Neue Version erstellen | Erstellt eine neue Version des UDI Stammdatensatzes. |
| Version freigeben | Gibt die aktuell Version frei. |
| Öffne DI Versionen | Öffnet die Übersicht vorhandener DI Versionen eines UDI Stammdatensatzes. |
| Audit Trail | Öffnet das Änderungsprotokoll des EUDAMED Datensatzes. |
UDI-DI Karte#
Die UDI-DI Stammdaten können in der UDI-DI Karte eingegeben werden. Hierzu wählen Sie zunächst einen Datensatz aus der "Base DI Liste“ aus, welcher die "DI Art = UDI-DI“ aufweist. Rufen Sie sich anschließend den Menüpunkt "EUDAMED Datensatz erstellen“ für die Erstanlage oder "Öffne DI-Karte“ zur Bearbeitung einer bereits bestehenden Karte, auf.
Die Felder sind entsprechend des UDI Data Dictionary zu befüllen. Felder, die nicht dem Data Dictionary entstammen sind in Deutsch und im Folgenden aufgeführt:
Inforegister Allgemein#
| Feld | Beschreibung |
|---|---|
| Beschreibung | Es kann ein freier Beschreibungstext zugewiesen werden. |
| Freigegeben | Gibt an, ob die Version des Datensatzes freigegeben wurde. |
| Aktiv | Kennzeichnet die Version welche aktuell bearbeitet wird oder zuletzt bearbeitet wurde. |
| Interne Version | Gibt die Version an. |
Menüband#
| Feld | Beschreibung |
|---|---|
| Neue Version erstellen | Erstellt eine neue Version des UDI Stammdatensatzes. |
| Version freigeben | Gibt die aktuell Version frei. |
| Öffne DI Versionen | Öffnet die Übersicht vorhandener DI Versionen eines UDI Stammdatensatzes. |
| Öffne Artikelverknüpfungen | Ordnet eine UDI-DI einem Artikel sowie ggf. dessen Variante und Einheitencode zu. |
| Audit Trail | Öffnet das Änderungsprotokoll des EUDAMED Datensatzes. |
Aktionen - Funktionen#
| Feld | Beschreibung |
|---|---|
| Legacy Daten kopieren | Kopiert die UDI Stammdaten von einem anderen UDI Stammdatensatz |
| Basic UDI Verknüpfung löschen | Löscht die zugeordnete Basic UDI. |
| Secondary UDI Verknüpfung löschen | Löscht die zugeordnete Secondary UDI. |
| Unit of Use DI Verknüpfung löschen | Löscht die zugeordnete Unit of Use DI. |
| Direct Marking DI Verknüpfung löschen | Löscht die zugeordnete Direct Marking DI. |
| Related Legacy Device Verknüpfung löschen | Löscht das zugeordnete Legacy Device. |
| Product Designer Link Verknüpfung löschen | Löscht die zugeordnete Verknüpfung zum Product Designer. |
Legacy Device Karte#
Die UDI-DI Stammdaten können in der Legacy Device Karte eingegeben werden. Dabei sind die Felder entsprechend des UDI Data Dictionary zu befüllen. Felder, die nicht dem Data Dictionary entstammen sind in Deutsch und im Folgenden aufgeführt.
Inforegister Basic UDI#
| Feld | Beschreibung |
|---|---|
| Beschreibung | Es kann ein freier Beschreibungstext zugewiesen werden. |
| Freigegeben | Gibt an, ob die Version des Datensatzes freigegeben wurde. |
| Aktiv | Kennzeichnet die Version welche aktuell bearbeitet wird oder zuletzt bearbeitet wurde. |
| Interne Version | Gibt die Version an. |
Menüband#
| Feld | Beschreibung |
|---|---|
| Neue Version erstellen | Erstellt eine neue Version des UDI Stammdatensatzes. |
| Version freigeben | Gibt die aktuell Version frei. |
| Öffne DI Versionen | Öffnet die Übersicht vorhandener DI Versionen eines UDI Stammdatensatzes. |
| Öffne Artikelverknüpfungen | Ordnet eine UDI-DI einem Artikel sowie ggf. dessen Variante und Einheitencode zu. |
| Audit Trail | Öffnet das Änderungsprotokoll des EUDAMED Datensatzes. |
Aktionen - Funktionen#
| Feld | Beschreibung |
|---|---|
| Legacy Daten kopieren | Kopiert die UDI Stammdaten von einem anderen UDI Stammdatensatz |
| Secondary UDI Verknüpfung löschen | Löscht die zugeordnete Secondary UDI. |
| Unit of Use DI Verknüpfung löschen | Löscht die zugeordnete Unit of Use DI. |
| Direct Marking DI Verknüpfung löschen | Löscht die zugeordnete Direct Marking DI. |
| Product Designer Link Verknüpfung löschen | Löscht die zugeordnete Verknüpfung zum Product Designer. |
Einrichtungen UDI - GUDID in KUMAVISION#
UDI Einrichtung#
In der "UDI Einrichtung“ werden die grundlegenden Einrichtungen auf dem Inforegister "Allgemein“ und "GUDID“ wie folgt vorgenommen:
| Feld | Beschreibung |
|---|---|
| Standard Zuteilungsstelle | Die Standard Zuteilungsstelle. |
| DUNS Number | Die von der FDA vergebene DUNS-Nummer identifiziert das meldende Unternehmen. Diese Daten werden auf Belegen und bei der Meldung verwendet. |
| Export zulassen trotz fehlgeschlagener XSD Validierung | Der XML-Export wird trotz fehlgeschlagener XSD-Validierung erlaubt. |
| GUDID XSD Validierung aktivieren | Die XSD-Validierung wird aktiviert, dazu muss eine entsprechende XSD-Datei hinterlegt sein. |
| GUDID XSD vorhanden | Zeigt an, ob eine XSD-Datei für die Validierung im XML-Export hinterlegt ist. |
Menüband Aktionen#
| Feld | Beschreibung |
|---|---|
| Neue Base DI | Erstellt eine neue DI (BASIC-DI, UDI-DI, Secondary DI usw.) |
| GUDID XSD importieren | Ermöglicht den Import der GUDID XSD-Datei. |
| GUDID XSD löschen | Löscht die hinterlegte GUDID XSD-Datei. |
Menüband Zugehörig#
Unter dem Menüpunkt "Zugehörig“ > "Stammdaten“ > "GUDID“ bzw. "Zugehörig“ > "Udi“ haben Sie die Möglichkeit zur zentralen Stammdatenpflege. Dabei sind die folgenden Beschreibungen der Global Unique Device Identification Database (GUDID) der U.S. Food and Drug Administration entnommen:
| Aufruf | Beschreibung |
|---|---|
| Measure Units | Unit of measure, wird genutzt für Clinical relevant size und Storage Handling Conditions. |
| FDA Product Code | Categorization for devices used by the FDA. |
| GMDN Codes / FDA Preferred Term Codes | GMDN Preferred Term (PT) Code is a unique five-digit code used to identify common device types. This PT Code is assigned to medical devices and related health care products for the purposes of grouping and categorization. |
| Clinic Relevant Size | Dimension type for the clinically relevant measurement of the medical device. |
| Submision Types | Type of the FDA Premarket Submission number, included are 510(k), De Novo, PMA, PDP, HDE, BLA, ANDA and NDA. |
| Storage Handling Conditions | Indicates storage and handling requirements that are required for the device including temperature, humidity, and atmospheric pressure. |
| Sterilization Methods | Indicates the method(s) of sterilization that can be used for this device prior to device use on the patient. |
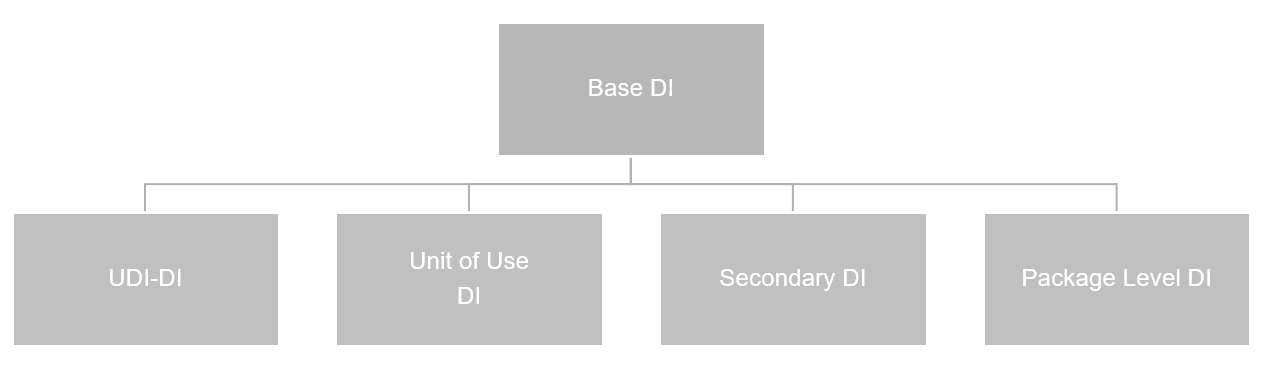
Base DI Liste#
Bei dieser Liste handelt es sich um die zentrale Liste in der sämtliche DIs hinterlegt sind.
Nachfolgende Grafik demonstriert, welche DIs für die GUDID Datenbank relevant sind:
Die Einrichtungen für die UDI – GUDID ist an dieser Stelle identisch zu der beschriebenen Einrichtung der UDI – EUDAMED. Entnehmen Sie bitte die Einrichtung hier.